Галогены (от греч. halos – соль и genes – рождающий, рождённый) находятся в главной подгруппеVII группы периодической системы химических элементов.К галогенам относят фтор, хлор, бром, иод и астат. 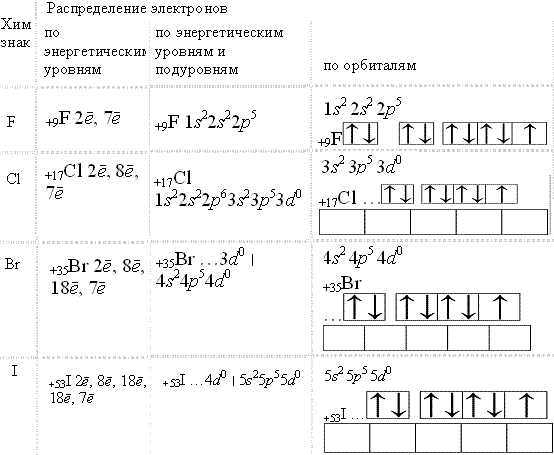
На наружном энергетическом уровне атомов галогенов находятся семь электронов: 
 До восьми электронов (октета) на наружном энергетическом уровне, т.е. до
устойчивого состояния атомов, характерного для благородных газов, атомам галогенов
недостаёт по одному электрону. К тому же атомы галогенов по
сравнению с атомами металлов того же периода обладают бόльшим зарядом ядра,
меньшим атомным радиусом и имеют по одному неспаренному электрону.
Поэтому атомы всех галогенов энергично присоединяют недостающий электрон. Например, Cl0 + ē
→ Cl–. Фтор в химических реакциях проявляет только окислительные свойства, и для
него характерна степень окисления –1. Остальные галогены могут проявлять и
восстановительные свойства при взаимодействии с более электроотрицательными
элементами – фтором, кислородом, азотом, при этом степени их окисления могут принимать
значения +1, +3, +5, +7. Восстановительные свойства галогенов усиливаются
от хлора к йоду, что связано с ростом радиусов их атомов: атомы хлора примерно
вдвое меньше, чем у йода. Глава I.
Свойства галогенов 1.1. Физические свойства
Вещество
|
Агрегатное
состояние
при обычных
условиях
|
Цвет
|
Запах
|
Температура
плавления,
°С
|
Температура
кипения, °С
|
Фтор
F2
|
Газ
|
Светло-жёлтый
| Резкий,
раздражающий |
–220
|
–188
|
Хлор
Cl2
|
Газ
|
Жёлто-зелёный
| Резкий,
удушливый |
–101
|
–34
|
Бром
Br2
|
Жидкость
|
Буровато-коричневый
| Резкий,
зловонный |
–7
|
+58
|
Иод
I2
|
Твёрдое
вещество
| Чёрно-фиолетовый
с металлическим
блеском |
Резкий
|
+114
|
+186
|
А) Фтор Фтор (лат. Fluorum), F – химический элемент VII группы периодической системы Менделеева,
относится к галогенам, атомный номер 9, атомная масса 18,998403; при нормальных
условиях (0 °С; 0,1 Мн/м2, или 1 кгс/см2) - газ бледно-жёлтого цвета с резким запахом. Природный фтор состоит из одного стабильного изотопа 19F.
Искусственно получены пять радиоактивных изотопов: 16F с
периодом полураспада Т1/2 < 1 сек, 17F(Т1/2 = 70 сек), 18F (Т1/2 = 111 мин), 20F
(Т1/2 = 11,4 сек), 21F(Т1/2 = 5 сек). Среднее содержание фтора в земной коре 6,25*10-2% по массе; в кислых изверженных породах (гранитах) оно составляет
8*10-2%,
в основных
- 3,7*10-2%, в ультраосновных
– 10-2%.
Фтор присутствует в вулканических газах и термальных водах. Важнейшие соединения фтора - флюорит, криолит и топаз. Всего известно 86 фторсодержащих минералов.
Соединения фтора находятся также в апатитах, фосфоритах и других. Фтор - важный биогенный
элемент. В истории Земли источником поступления фтора в биосферу были продукты
извержения вулканов (газы и др.). Газообразный фтор имеет плотность 1,693 г/л (0 °С и 0,1 Мн/м2, или 1 кгс/см2),
жидкий - 1,5127 г/см3 (при температуре кипения); tпл -219,61 °С; tкип -188,13 °С. Молекула
фтора состоит из двух атомов (F2); при 1000 °С 50% молекул диссоциирует, энергия диссоциации около 155±4 кдж/моль (37±1 ккал/моль). Фтор плохо растворим в жидком фтористом водороде; растворимость
2,5*10-3 г в 100 г НF при -70 °С и 0,4*10-3 г при -20 °С;
в жидком виде неограниченно растворим в жидком кислороде и озоне. Конфигурация
внешних электронов атома фтора 2s2 2р5. В соединениях проявляет степень окисления
-1. Ковалентный радиус атома 0,72А, ионный радиус 1,33А. Сродство к электрону
3,62 эв, энергия ионизации (F ® F+) 17,418 эв. Высокими значениями сродства к
электрону и энергии ионизации объясняется сильная электроотрицательность
атома фтора, наибольшая среди всех других элементов.
Высокая реакционная способность фтора обусловливает экзотермичность фторирования,
которая, в свою очередь, определяется аномально малой величиной энергии диссоциации
молекулы фтора и большими величинами энергии связей атома фтора с другими атомами. Б) Хлор Хлор (лат. Chlorum), Cl - химический элемент VII группы периодической системы Менделеева,
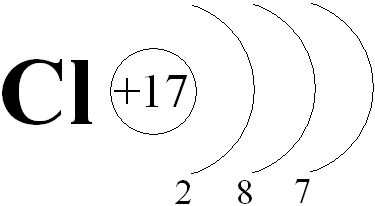
атомный номер 17, атомная масса 35,453; относится к семейству галогенов. При нормальных условиях (0 °С, 0,1 Мн/м2) жёлто-зелёный газ с резким раздражающим запахом. Природный хлор состоит из двух стабильных изотопов: 35Cl (75,77%) и
37Cl (24,23%). Искусственно получены радиоактивные изотопы с массовыми числами
32, 33, 34, 36, 38, 39, 40 и периодами полураспада
Т1/2 соответственно
0,31; 2,5; 1,56 сек; 3,1*105
лет; 37,3; 55,5 и 1,4
мин. 36Cl и 38Cl
используются как изотопные индикаторы. Xлор встречается в природе только в виде соединений.
Среднее содержание хлора в земной коре
1,7*10-2%
по массе, в кислых изверженных породах - гранитах
2,4*10-2, в основных и ультраосновных 5*10-3.
Основную роль в истории хлора в земной коре играет водная миграция.
В виде иона Cl- он содержится в Мировом океане (1,93%), подземных
рассолах и соляных озерах.
Число собственных минералов (преимущественно природных хлоридов) 97, главный из
них - галит NаCl.
Известны также крупные месторождения хлоридов калия и магния и смешанных
хлоридов: сильвин КCl, сильвинит (Nа, К) Cl, карналлит КCl*МgCl2*6Н2О, каинит КCl*МgSO4*ЗН2О, бишофит МgCl2*6Н2О. В истории Земли большое значение имело поступление содержащегося
в вулканических газах НCl в верхние части земной коры. Xлор имеет tкип - 34,05 °С, tпл - 101 °С. Плотность газообразного хлора при
нормальных условиях 3,214 г/л; насыщенного пара при 0 °С 12,21 г/л; жидкого
хлора при температуре кипения 1,557 г/см3; твёрдого хлора при -102 °С 1,9 г/см3. Давление
насыщенных паров хлора при 0 °С 0,369; при 25 °С 0,772; при 100 °С 3,814 Мн/м2
или соответственно 3,69; 7,72; 38,14 кгс/см2. Теплота плавления 90,3 кдж/кг (21,5
кал/г); теплота испарения 288 кдж/кг (68,8 кал/г); теплоёмкость газа при постоянном
давлении 0,48 кдж/(кг*К) [0,11 кал/(г*°С)].
Xлор хорошо растворяется в ТiСl4, SiCl4, SnCl4 и некоторых органических
растворителях (особенно в гексане и четырёххлористом углероде). Молекула
хлора двухатомна (Cl2).
Степень термической диссоциации Cl2+243 кдж Ы 2Cl при 1000 К равна 2,07*10-4%,
при 2500 К 0.909%. Внешняя электронная конфигурация атома Сl Зs2 3р5. В соответствии с этим хлор
в соединениях проявляет степени окисления -1, +1, +3, +4, +5, +6 и +7. Ковалентный
радиус атома 0,99А, ионный радиус Сl- 1,82А, сродство атома хлора
к электрону 3,65 эв, энергия ионизации 12,97 в. В) Бром Бром (лат. Bromum), Br - химический элемент
VII группы периодической системы Менделеева, относится к галогенам,
атомный номер 35, атомная масса 79,904; красно-бурая жидкость с
сильным неприятным запахом. Бром открыт в 1826 французским химиком А. Ж.
Баларом при изучении рассолов средиземноморских соляных промыслов; назван от греческого
bromos – зловоние.
Природный бром состоит из 2 стабильных изотопов 79Br (50,34%) и 81Br (49,46%). Из искусственно полученных радиоактивных изотопов брома наиболее интересен 80Вr, на примере
которого И. В. Курчатовым открыто явление изомерии атомных ядер. Содержание брома в земной коре (1,6*l0-4% по массе) оценивается в 1015-1016 т. В главной
своей массе бром находится в рассеянном состоянии в магматических породах, а также
в широко распространённых галогенидах. Бром - постоянный спутник хлора.
Бромистые соли (NaBr, KBr, MgBr2) встречаются в отложениях хлористых солей
(в поваренной соли до 0,03% Br, в калийных солях - сильвине и карналлите - до 0,3% Вr), а
также в морской воде (0,065% Br), рапе соляных озёр (до 0,2% Br) и подземных
рассолах, обычно связанных с соляными и нефтяными месторождениями
(до 0,1% Br). Благодаря хорошей растворимости в воде бромистые соли накопляются
в остаточных рассолах морских и озёрных водоёмов.
Бром мигрирует в виде легко растворимых соединений, очень редко образуя твёрдые минеральные формы, представленные бромиритом AgBr, эмболитом Ag (Сl, Br) и
иодэмболитом Ag (Сl, Вr, I).
Образование минералов происходит в зонах окисления сульфидных серебро-содержащих
месторождений, формирующихся в засушливых пустынных
областях. При -7,2°С жидкий бром застывает, превращаясь в красно-коричневые игольчатые
кристаллы со слабым металлическим блеском. Пары брома жёлто-бурого цвета, tкип 58,78°С.
Плотность жидкого брома (при 20°С) 3,1 г/см3. В воде бром растворим ограниченно, но лучше других галогенов (3,58 г брома в 100 г Н2О при 20°С). Ниже 5,84°С из воды осаждаются
гранатово-красные кристаллы Br2*8H2O. Особенно хорошо растворим бром во многих
органических растворителях, чем пользуются для извлечения его из водных растворов. Бром
в твердом, жидком и газообразном состоянии состоит из 2-атомных молекул.
Заметная диссоциация на атомы начинается при температуре около 800°С; диссоциация
наблюдается и при действии света. Г) Иод Иод (лат. Iodium), I - химический элемент VII группы периодической системы Менделеева,
относится к галогенам (в литературе встречается также символ J); атомный номер 53, атомная масса 126,9045; кристаллы черно-серого цвета с металлическим блеском. Природный
иод состоит из одного стабильного изотопа с массовым числом 127.
Иод открыл в 1811 французский химик Б. Куртуа.
Нагревая маточный рассол золы морских водорослей с концентрированной
серной кислотой, он наблюдал выделение фиолетового пара (отсюда название иод
- от греческого iodes, ioeides - похожий цветом на фиалку, фиолетовый),
который конденсировался в виде темных блестящих пластинчатых кристаллов. В 1813 - 1814 французский химик Ж.Л. Гей-Люссак и английский химик Г. Дэви доказали элементарную
природу иода. Среднее содержание иода в земной коре 4*10-5% по массе. В мантии и магмах и в
образовавшихся из них породах (гранитах, базальтах) соединения иода рассеяны;
глубинные минералы иода неизвестны.
История иода в земной коре тесно связана с живым веществом и биогенной миграцией. В
биосфере наблюдаются процессы его концентрации, особенно морскими организмами
(водорослями, губками). Известны 8 гипергенных минералов иода, образующихся
в биосфере, однако они очень редки.
Основным резервуаром иода для биосферы служит Мировой
океан (в 1 литре в среднем содержится 5*10-5 грамм иода). Из океана соединения
иода, растворенные в каплях морской воды, попадают в атмосферу и переносятся
ветрами на континенты. Местности, удаленные от океана или отгороженные от морских
ветров горами, обеднены иодом. Иод легко адсорбируется органическими веществами
почв и морских илов. При уплотнении этих илов и образовании осадочных горных пород
происходит десорбция, часть соединений иода переходит в подземные воды. Так образуются
используемые для добычи иода иодо-бромные воды, особенно характерные для районов
нефтяных месторождений (местами 1 литр этих вод содержит свыше 100 мг иода). Плотность иода 4,94 г/см3,
tпл 113,5 °С,
tкип 184,35 °С.
Молекула жидкого и газообразного иода состоит из двух атомов (I2).
Заметная диссоциация
I2 Ы 2I наблюдается выше 700 °С, а также при действии света. Уже при
обычной температуре иод испаряется, образуя резко пахнущий фиолетовый
пар. При слабом нагревании иод возгоняется, оседая в виде блестящих
тонких пластинок; этот процесс служит для очистки иода в лабораториях и в промышленности.
Иод плохо растворим в воде (0,33 г/л при 25 °С), хорошо - в сероуглероде и органических
растворителях (бензоле, спирте), а также в водных растворах иодидов. Пары иода ядовиты и раздражают слизистые оболочки. На кожу иод оказывает
прижигающее и обеззараживающее действие. Пятна от иода смывают растворами соды или тиосульфата натрия. Д) Астат Астат (лат. Astatium) - один из важнейших радиоактивных химических элементов в природе. Он
относится к VII группе периодической системы Менделеева. Атомный номер – 85. У астата нет стабильных изотопов.
Радиоактивных изотопов астата, открытых к данному времени около 20, все они
очень неустойчивы.
Наиболее долгоживущий 210At имеет период полураспада T 1/2 8,3 ч. Именно по этой причине
в земном поверхностном слое (1,6 км), как показали расчеты, содержится 69 мг астата-218. Это
очень мало. Как чистый металл астат обладает уникальным свойством – возгоняется в молекулярной
форме из водных растворов, такой способности нет ни у одного из известных элементов. Астат легко испаряется как в обычных условиях, так и в вакууме. А также хорошоадсорбируется
на металлах - Ag, Au, Pt. Именно благодаря этим свойствам удается выделить астат из продуктов облучения висмута. Этого добиваются путем их вакуумной дистилляции с поглощением астата серебром или платиной (до 85%). 1.2. Химические свойства I. Взаимодействие с неорганическими веществами:
Взаимодействие с металлами:
2Al + 3F2 = 2AlF3Sn + Cl2  SnCl2 SnCl2 2Fe
+ 3Cl2  2FeCl3 2FeCl3
Cu
+ Br2  CuBr2 CuBr2 Zn + I2 = ZnI2
Взаимодействие с водородом:
Cl2
+ H2  2HCl 2HCl
Взаимодействие с водой:
Cl2 + H2O = HCl + HClO
Хлорноватистая кислота
2Br2 + 2H2O = 4HF + O2. 4. Взаимодействие со щелочами: Cl2 + 2KOH = KClO + KCl + H2O
(без нагревания) 3Cl2
+ 6KOH  KClO3 KClO3
+ 5KCl
+ 3H2O
(с нагреванием) 5. Взаимодействие с галогенидами – соединениями галогенов с металлами:фтор вытесняет из солей хлор, бром, йод: 2NaCl + F2 = 2NaF + Cl2 2KBr + F2 = 2KF + Br2 хлор вытесняет из солей бром, йод: 2KBr + Cl2 = 2KCl + Br2 бром вытесняет из солей йод: 2KI + Br2 = 2KBr + I2↓. II. Взаимодействие органическими веществами (галогенирование - присоединение галогена). Галогены взаимодействуют со всеми классами органических соединений. Рассмотрим
некоторые реакции: 1. С алканами: CH3–CH3 + Cl2 → CH2Cl–CH3 + HCl хлорэтан 2. С алкенами: CH2=CH2 + Br2 → CH2Br–CH2Br 1,2-дибромэтан 3. С алкинами: CH≡CH + Br2 → CHBr=CHBr 1,2-дибромэтен Глава II.
Получение и применение Фтор. Источником для производства фтора служит фтористый водород, получающийся
в основном либо при действии серной кислоты H2SO4 на флюорит CaF2, либо при переработке
апатитов и фосфоритов.
Производство фтора осуществляется электролизом расплава кислого фторида калия,
который образуется при насыщении расплава KF*HF фтористым
водородом до содержания 40-41% HF. Материалом для электролизера обычно служит
сталь; электроды - угольный анод и стальной катод. Электролиз ведется при 95-100 °С и напряжении 9-11 в; выход фтора по току достигает 90-95%. Получающийся фтор содержит до 5% HF, который удаляется вымораживанием с последующим поглощением фторидом натрия.
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе, из меди, алюминия и его сплавов, латуни нержавеющей стали. Газообразный фтор служит для фторирования UF4 в UF6, применяемого для изотопов разделения
урана, а также для получения трех-фтористого хлора СlF3 (фторирующий агент), шестифтористой серы SF6 (газообразный изолятор в электротехнической промышленности),
фторидов металлов (например, W и V). Жидкий фтор - окислитель ракетных топлив. Широкое применение получили многочисленные соединения фтора - фтористый
водород, алюминия фторис), кремне-фториды, фторсульфоновая кислота (растворитель,
катализатор, реагент для получения органических соединений, содержащих группу - SO2F),
ВF3 (катализатор), фторорганические соединения и др. Хлор. Xлор начали производить в промышленности в 1785 взаимодействием соляной кислоты с двуокисью марганца или пиролюзитом. В 1867 английский химик Г. Дикон разработал способ получения хлора окислением НСl кислородом воздуха п присутствии катализатора.
С конца 19 - начала 20 веков хлор получают электролизом водных растворов хлоридов щелочных
металлов. По этим методам в 70-х годах 20 века производится 90 - 95% хлора в мире.
Небольшие количества хлора получаются попутно при производстве магния, кальция, натрия и лития электролизом расплавленных хло ридов. В 1975 году мировое
производство хлора составляло около 23 млн. тонн. Применяются два основных метода электролиза водных растворов NаСl: 1) в электролизёрах с твёрдым катодом и пористой фильтрующей диафрагмой;
2) в электролизёрах с ртутным катодом. По обоим методам на графитовом или окисном титано-рутениевом аноде выделяется газообразный хлор. По первому методу на катоде выделяется
водород и образуется раствор NаОН и NаСl, из которого последующей переработкой
выделяют товарную каустическую соду. По второму методу на катоде образуется
амальгама натрия, при её разложении чистой водой в отдельном аппарате получаются
раствор NаОН, водород и чистая ртуть, которая вновь идёт в производство.
Оба метода дают на 1 тонну хлора 1,125 тонны NаОН. Электролиз с диафрагмой требует меньших капиталовложений для организации производства хлора, дает более дешёвый NаОН. Метод с ртутным катодом позволяет получать очень
чистый NаОН, но потери ртути загрязняют окружающую среду. В 1970 по методу с ртутным катодом производилось 62,2% мировой выработки хлора, с твёрдым катодом 33,6% и прочими способами 4,3%. После 1970 начали применять электролиз с твёрдым катодом и ионообменной
мембраной, позволяющий получать чистый NаОН без использования ртути. Одной из важных отраслей химической промышленности является хлорная промышленность.
Основные количества хлора перерабатываются на месте его производства в хлорсодер
жащие соединения. Хранят и перевозят хлор в жидком виде в баллонах, бочках, железнодорожных цистернах или в специально оборудованных судах. Для индустриальных
стран характерно следующее примерное потребление хлора: на производство хлорсодержа
щих органических соединений - 60 - 75%; неорганических соединений, содержащих
хлор, -10 - 20%; на отбелку целлюлозы и тканей - 5 - 15%; на санитарные нужды и хлорирование воды - 2 - 6% от общей выраобтки. Xлор применяется также для хлорирования некоторых руд с целью извлечения титана, ниобия,
циркония и других. Бром. Исходным сырьём для получения брома служат морская вода, озёрные и подземные рассолы и щелока калийного произва, содержащие бром в виде бромид-иона Вг-. Бром выделяют
при помощи хлора и отгоняют из раствора водяным паром или воздухом.
Отгонку паром ведут в колоннах, изготовленных из гранита, керамики или иного стойкого
к брому материала. Сверху в колонну подают подогретый рассол, а снизу - хлор и водяной
пар. Пары брома, выходящие из колонны, конденсируют в керамиковых холодильниках.
Далее бром отделяют от воды и очищают от примеси хлора дистилляцией.
Отгонка воздухом позволяет использовать для получения брома рассолы с его низким
содержанием, выделять бром из которых паровым способом в результате большого расхода
пара невыгодно. Из получаемой бромовоздушной смеси бром улавливают химическими
поглотителями.
Для этого применяют растворы бромистого железа, которое, в свою очередь, получают восстановлением FеВг3 железными стружками, а акже растворы гидроокисей или карбонатов
натрия или газообразный сернистый ангидрид, реагирующий с бромом в присутствии
паров воды с образованием оромистоводородной и серной кислот.
Из полученных полупродуктов бром выделяют действием хлора или кислоты.
В случае необходимости полупродукты перерабатывают на бромистые
соединения, не выделяя элементарного брома. Вдыхание паров брома при содержании их в воздухе 1 мг/м3 и более вызывает кашель,
насморк, носовое кровотечение, головокружение, головную боль; при более высоких
концентрациях - удушье, бронхит, иногда смерть. Предельно допустимые концентрации паров брома в воздухе 2 мг/м3. Жидкий бром действует
на кожу, вызывая плохо заживающие ожоги, Работы с бромом следует проводить в вытяжных шкафах. При отравлении парами брома рекомендуется вдыхать аммиак, используя для этой цели
сплыю разбавленный раствор его в воде или в этиловом спирте.
Боль в горле, вызванную вдыханием паров брома, устраняют приёмом внутрь горячего молока.
Бром, попавший на кожу, смывают большим количеством воды или сдувают сильной струей
воздуха. Обожжённые места смазывают ланолином. Бром применяют довольно широко. Он - исходный продукт для получения ряда бромистых солей
и органических производных.
Большие количества брома расходуют для получения бромистого этила и дибромэтана
- составных частей этиловой жидкости, добавляемой к бензинам для повышения их детонационной стойкости.
Соединения брома применяют в фотографии, при производстве ряда красителей,
бромистый метил и некоторые другие соединения брома - как инсектициды. Некоторые органические соединения брома служат эффективными огнетушащими средствами.
Бром и бромную воду используют при химических анализах для определения многих веществ.
В медицине используют бромиды натрия, калия, аммония, а также органичанические
соединения брома, которые применяют при неврозах, истерии, повышенной раздражительности,
бессоннице, гипертонические болезни, эпилепсии и хорее. Иод. Сырьем для промышленного получения иода в России служат нефтяные буровые
воды; за рубежом - морские водоросли, а также маточные растворы чилийской (натриевой)селитры, содержащие до 0,4% иода в виде иодата натрия. Для извлечения
иода из нефтяных вод (содержащих обычно 20 - 40 мг/л иода в виде иодилов) на них
сначала действуют хлором или азотистой кислотой.
Выделившийся иод либо адсорбируют активным углем, либо выдувают воздухом. На иод, адсорбированный углем, действуют едкой щелочью или сульфитом натрия. Из продуктов
реакции свободный иод выделяют действием хлора или серной кислоты и окислителя,
например дихромата калия. При выдувании воздухом иод поглощают смесью двуокиси
серы с водяным паром и затем вытесняют иод хлором. Сырой кристаллический иод очищают
возгонкой. Иод и его соединения применяют главным образом в медицине и в аналитической
химии, а также в органическом синтезе и фотографии.
В промышленности применение иода пока незначительно по объему, но весьма перспективно.
Так, на термическом разложении иодидов основано получение высокочистых металлов. Астат широкого применения не имеет. Заключение В заключение несколько слов о галогенах как об элементах в клетках нашего организма. Фтор постоянно входит в состав животных и растительных тканей; микроэлементов. В виде неорганических соединений содержится главным образом в костях животных и человека - 100-300 мг/кг; особенно много фтора в зубах. Кости морских животных богаче фтором
по сравнению с костями наземных.
Поступает в организм животных и человека преимущественно с питьевой водой, оптимальное
содержание фтора в которой 1-1,5 мг/л. При недостатке фтора у человека развивается
кариес зубов, при повышенном поступлении - флюороз. Высокие концентрации ионов фтора
опасны ввиду их способности к ингибированию ряда ферментативных реакций, а также
к связыванию важных в биологическом отношении элементов (Р, Са, Мg и др.), нарушающему их баланс в организме.
Органические производные фтора обнаружены только в некоторых растениях (например, в
южноафриканском Dicha petalum cymosum). Основные из них - производные фторуксусной кислоты, токсичные как для других растений, так и для животных.
Биологическая роль изучена недостаточно. Установлена связь обмена фтора с образованием
костной ткани скелета и особенно зубов. Необходимость фтора для растений
не доказана. Xлор - один из биогенных элементов, постоянный компонент тканей растений и животных.
Содержание хлора в растениях (много хлора в галофитах) - от тысячных долей процента
до целых процентов, у животных - десятые и сотые доли процента. Суточная
потребность взрослого человека в хлоре, (2 - 4 г) покрывается за счёт пищевых
продуктов. С пищей хлор поступает обычно в избытке в виде хлорида натрия и хлорида
калия. Особенно богаты хлором хлеб, мясные и молочные продукты. В организме животных хлор - основное осмотически активное вещество плазмы крови, лимфы, спинномозговой
жидкости и некоторых тканей. Играет роль в водно-солевом обмене, способствуя
удержанию тканями воды.
Регуляция кислотно-щелочного равновесия в тканях осуществляется наряду с другими
процессами путём изменения в распределении хлора между кровью и другими тканями,
хлор участвует в энергетическом обмене у растений, активируя как окислительное
фосфорилирование, так и фотофосфорилирование.
Xлор положительно влияет на поглощение корнями кислорода.
Xлор необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами. В состав большинства питательных сред для искусственного
культивирования растений хлор не входит.
Возможно, для развития растений достаточны весьма малые концентрации хлора. Бром - постоянная составная часть тканей животных и растений.
Наземные растения содержат в среднем 7*10-4% брома на сырое вещество, животные ~10-4%. Бром найден в различных секретах (слезах, слюне, поте, молоке, желчи).
В крови здорового человека содержание брома колеблется от 0,11 до 2,00 мг%. С помощью
радиоактивного брома (82Br) установлено избирательное поглощение его щитовидной
железой, мозговым слоем почек и гипофизом.
Введённые в организм животных и человека бромиды усиливают концентрацию
процессов торможения в коре головного мозга, содействуют нормализации
состояния нервной системы, пострадавшей от перенапряжения тормозного
процесса. Одновременно, задерживаясь в щитовидной железе, бром вступает в конкурентные
отношения с иодом, что влияет на деятельность железы, а в связи с этим - и на состояние
обмена веществ. Иод - необходимый для животных и человека микроэлемент.
В почвах и растениях таежно-лесной нечерноземной, сухостепной, пустынной и
горных биогеохимических зон. Иод содержится в недостаточном
количестве или не сбалансирован с некоторыми другими микроэлементами
(Со, Мn, Сu); с этим связано распространение в этих зонах эндемического
зоба. Среднее содержание иода в почвах около 3*10-4%, в растениях около 2*10-5%.
В поверхностных питьевых водах иода мало (от 10-7 до 10-9%).
В приморских областях количество иода в 1 м3 воздуха может
достигать 50 мкг, в континентальных и горных - составляет 1 или даже 0,2 мкг. Поглощение иода растениями зависит от содержания в почвах его соединений
и от вида растений.
Некоторые организмы (так называемые концентраторы иода, например морские водоросли - фукус, ламинария, филлофора, накапливают до 1% иода, некоторые губки - до 8,5% (в скелетном веществе спонгине).
Водоросли, концентрирующие иод, исиспользуются для его промышленного получения. В
животный организм иод поступает с пищей, водой, воздухом. Основной источник иода
- растительные продукты и корма. Всасывание иода происходит в передних
отделах тонкого кишечника. В организме человека
накапливается от 20 до 50 мг иода, в том числе в мышцах около 10 - 25 мг,
в щитовидной железе в норме 6 - 15 мг. С помощью радиоактивного
иода (131I и 125I) показано, что в щитовидной железе иод накапливается в митохондриях
эпителиальных клеток и входит в состав образующихся в них дииод- и моноиодтирозинов,
которые конденсируются в гормон тетраиодтиронин (тироксин).
Выделяется иод из организма реимущественно через почки (до 70 - 80%), молочные, слюнные и потовые железы, частично с жёлчью. В различных биогеохимических провинциях содержание иода в суточном рационе колеблется
(для человека от 20 до 240 мкг, для овцы от 20 до 400 мкг). Потребность животного в иода зависит от его физиологического состояния, времени года, температуры, адаптации
организма к содержанию иода в среде.
Суточная потребность в иоде человека и животных - около 3 мкг на 1 кг массы (возрастает
при беременности, усиленном росте, охлаждении).
Введение в организм иода повышает основной обмен, усиливает окислительные
процессы, тонизирует мышцы, стимулирует половую функцию. В связи с большим или меньшим недостатком иода в пище и воде применяют
иодирование поваренной соли, содержащей обычно 10 - 25 г йодистого калия на 1
тонну соли. Применение удобрений, содержащих иод, может удвоить
и утроить его содержание в сельскохозяйственных культурах.
|



 SnCl2
SnCl2