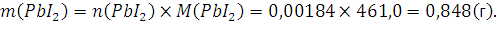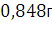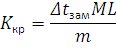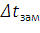| Главная » Статьи » Химия » Химия |
Окислительно-восстановительные реакции органических веществКонтрольная работа по общей химии 12. Органическое вещество в виде летучей жидкости массой 0,1437 г при 25 °С и Р=99,2 кПа превращено в пар, занимающий объем 22,9 мл. Найдите молярную массу этого вещества. Решение: Уравнение состояния идеального газа (принимаем, что наш пар подчиняется этому уравнению) Клапейрона-Менделеева: pV = nRT где p – давление газа, Па; V – объем газа, м³; n – число молей газа; R – универсальная газовая постоянная; T – абсолютная температура. При этом n = m/M’ где m – масса газа, г; M – его молярная масса. t = 25°Cили это 298,15 K.
Тогда
.
Ответ:. 39. Сколько м³ пропена С3Н6 сгорело, если в результате образовалось 50 кг паров воды, если t = 30°С, Р = 1,1атм? Решение: Уравнение реакции: 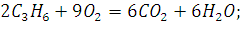
в
уравнении . Тогда использовав уравнение Клапейрона-Менделеева pV = nRTи n = m/M;
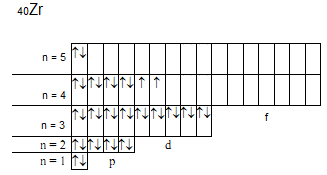
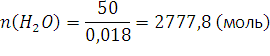 Получим 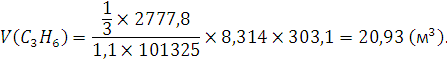 Ответ: 20,93м³. 62. Составьте электронные формулы атомов элементов с порядковыми номерами 14 и 40. Какие электроны тих атомов являются валентными? Решение: Элемент с порядковым номером 14 – кремний. Его электронная формула имеет вид: 1s22s22p63s23p2 Так как последний электрон находится на p-подуровне, то кремний относится к электронному p-семейству. Распределение электронов по квантовым ячейкам у атома кремния в нормальном состоянии:  Валентные электроны для кремния – s- и p-электроны внешнего электронного уровня. Элемент с порядковым номером 40 – цирконий. Его электронная формула имеет вид: 1s22s22p63s23p64s23d104p65s24d2. Так как последний электрон находится на d-подуровне, то цирконий относится к электронному d-семейству. Распределение электронов по квантовым ячейкам у атома циркония в нормальном состоянии:
Валентные электроны для циркония – d-электроны предвнешнего и s-электроны внешнего электронного уровней. Электронные и электронно-графические формулы элементов составлялись с учетом принципа Паули, правила Хунда и правила Клечковского. 87. Чем объясняется последовательное изменение окислительной способности свободных галогенов и восстановительной способности галогенид-ионов от фтора к йоду? Приведите примеры иллюстрирующих реакций. Решение: В ряду галогенов F2 - Cl2 - Br2 - I2 химическая активность и окислительная способность галогенов уменьшается, в связи с увеличением радиуса и уменьшением первого потенциала ионизации. Это можно проследить на примере реакции взаимодействия галогенов с водородом. Фтор взаимодействует с водородом с взрывом, выделяя при этом большое количество энергии. Хлор при обычных условиях очень медленно взаимодействует с водородом, но на прямом солнечном свету или при нагревании реакция идет также с взрывом. Реакция водорода и хлора протекает по цепному механизму, поэтому для нее необходимо инициирование (нагревание или освещение). Взаимодействие брома и йода с водородом происходит лишь при нагревании. Йод с водородом реагирует не полностью, т.к. йодоводород, образующийся при этом легко разлагается и равновесие сильно смещено в сторону исходных продуктов: Н2 + I2 <=> 2НI
Химическая активность галогенов от фтора к йоду уменьшается. Поэтому более активный галоген (имеющий наиболее высокое значение элетроотрицательности) вытесняет менее активный галоген из его соединений с металлами. Так, фтор вытесняет все другие галогены из их галогенидов, хлор – бром и иод, а бром – только иод: 2NаBr + С12 = 2NаС1 + Br2 2NаI + С12 = 2NаС1 + I2 2КI + Br2 = 2КBr + I2 2КBr + I2 ≠ Галогеноводородные кислоты (кроме HF) могут проявлять восстановительные свойства. Так как сродство к электрону (СЭ) в ряду галогенид-ионов уменьшается от Cl2 к I2, то восстановительные свойства в ряду HCl ‒ HBr – HI увеличиваются: HCl + H2SO4 (конц. ) ≠ 2НBr + H2SO4(конц.) = Br2 + SО2 + 2H2O 8НI + H2SO4(конц.) = 4I2 + H2S + 4H2O В связи с усилением восстановительных свойств галогеноводородов от НС1 к HI падает устойчивость водных растворов галогеноводородных кислот к воздействию кислорода воздуха. При хранении на воздухе концентрированных растворов иодоводорода происходит его окисление: 4HI + О2 = I2 + 2Н2О При этом раствор иодоводородной кислоты постепенно буреет: HI + I2 = Н[I3] Более медленно протекает аналогичный процесс и водном растворе НBr Задания Подберите коэффициенты в схемах окислительно-восстановительных реакций. Укажите окислитель и восстановитель. 112. Реакции № 12, 37, 62 Решение: №12: 2Mn(NO3)2 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3+ 5NaNO3 + 7H2O Восстановитель: Mn(NO3)2 Окислитель: NaBiO3
№37: 3HNO2 = HNO3 + 2NO + H2O Восстановитель: HNO2 Окислитель: HNO2 Данная окислительно-восстановительная реакция относится к реакциям диспропорционирования, т.к. молекулы одного и того же вещества (HNO2) способны окислять и восстанавливать друг друга. Это происходит потому, что вещество HNO2 содержит в своем составе атомы азота в промежуточной степени окисления (3+). Следовательно, степень окисления способна как понижаться, так и повышаться.
№62: NH3 + KMnO4 + KOH = KCl + K2MnO4 + H2O Некорректное условие – ошибка в реагентах (NH3) и продуктах реакции (KCl). Возможное правильное условие: KCl + 8KMnO4 + 8KOH = KClO4 + 8K2MnO4 + 4H2O Восстановитель: KCl Окислитель: KMnO4
143. При сгорании 1 л бутана С4Н10 выделилось 119,1 кДж теплоты. Вычислить энтальпию образования бутана. Условия нормальные. Решение: Уравнение реакции:
При
сгорании а при
сгорании 119,2/2=x/0,0446; x=2,65 (кДж).
Ответ:
выделится . 162. Возможно ли при 200°С протекание следующей реакции: СО + 0,5О2 = СО2? Решение: Возможно ли при 2000С протекание следующей реакции: СО + 0,5О2 = СО2? О принципиальной возможности и направлении процесса позволяют судить величина и знак ΔG (энергия Гиббса). ΔG = ΔH – TΔS, Окислительно-восстановительные реакции органических веществ
п - количество вещества
При ΔG<0 реакция самопроизвольно протекает в прямом направлении. Ответ: возможно, так как ∆G– отрицательная величина. 189. Температурный коэффициент скорости реакции равен 3. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры от 140 до 1700?
Ответ: Скорость реакции увеличится в 27 раз. 222. Как повлияет на выход хлора в системе : 4 HCl(г) + О2(г) « 2 Cl2(г) + 2 Н2О(ж), Q = 202,4 кДж, а) повышение температуры в системе, б) уменьшение общего объема смеси, в) уменьшение концентрации кислорода, г) увеличение общего объема реактора, д) введение катализатора? Решение: 4HCl(г) + О2(г) « 2Cl2(г) + 2Н2О(ж), Q = 202,4 кДж Прямая реакция происходит с выделением тепла, т.е. является экзотермической (Q > 0), следовательно, обратная реакция будет протекать с поглощением тепла, т.е. является эндотермической (Q < 0). Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы компенсировать изменение. а) повышение температуры в системе будет способствовать сдвигу равновесия в сторону реакции, протекающей с поглощением тепла (эндотермической), т.е. в сторону реакции образования исходных веществ – выход хлора при этом уменьшится. б) уменьшение общего объема смеси приведет к смещению равновесия в сторону реакции, протекающей с образованием меньшего числа молей газообразных веществ, т.е. в сторону прямой реакции – выход хлора при этом увеличится. в) при уменьшении концентрации кислорода равновесие сдвигается в направлении образования исходных веществ – выход хлора при этом уменьшится. г) при увеличении общего объема реактора давление в системе уменьшится, потому равновесие сдвинется в сторону увеличения числа газовых молей, т.е. в сторону обратной реакции – выход хлора при этом уменьшится. д) катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому на смещение равновесия влияния не оказывает, а только способствует более быстрому его достижению, поэтому введение катализатора на выход хлора не повлияет. 237. Составьте схему, напишите уравнения электродных процессов гальванического элемента, у которого один электрод цинковый с концентрацией ионов цинка 10-2 моль/л, а второй – водородный с концентрацией ионов водорода 10-2 моль/л. Рассчитайте э.д.с. этого элемента. Решение: Схема химической цепи:поток электронов
Электрод восстановитель (донор электронов) Электрод окислитель (акцептор электронов
где
Ответ:
Э.Д.С. равно . 262. Напишите уравнения реакций процессов, протекающих на электродах при электрохимической защите стальных труб. Решение: Одним из вариантов электрохимической защиты стальных труб есть протекторная защита. Если в качестве протектора взять цинк, то уравнения реакций процессов, протекающих на электродах будут следующие: анодный процесс: Zn – 2e- = Zn2+; катодный процесс: в кислой среде –2Н+ + 2е- = Н2↑; в нейтральной среде –1/2О2 + Н2О + 2е- = 2ОН-. 286. Вычислить рН 0,001 М раствора фтористоводородной кислоты и 0,00001 М раствора гидроксида натрия. Решение: Электролиты HF и NaOH есть сильными и потому в растворе диссоциируют полностью. Для указанных растворов имеем:
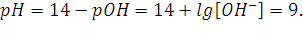 Ответ: 3 и 9. 312. Слили 30 г 2 %-ного раствора ацетата свинца Pb(CH3COO)2 и 50 мл 1 М раствора иодоводородной кислоты HI. Определите массу осадка иодида свинца. Решение: Уравнение реакции: 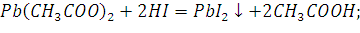
в
уравнении . Теперь рассчитаем какой реагент в избытке: 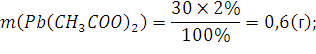
=
– находится в избытке, расчеты ведем по
Ответ:
. 337. В 70 г бензола С6Н6 растворено 2,09 г некоторого вещества. Раствор кристаллизуется при 4,250С. Установить молекулярную массу растворенного вещества. tкрист.бензола= 5,50С. Решение: Криоскопическая константа выражается формулой
где
Ккр
–
криоскопическая
константа; точки замерзания раствора, состоящего из т кг растворенного неэлектролита и L кг растворителя; М – масса 1 моль неэлектролита, кг. Криоскопическая константа бензола Ккр = 5,1°. Отсюда 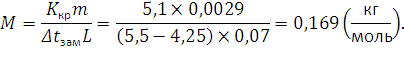
Ответ:
. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Просмотров: 3805 | | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Всего комментариев: 0 | |
| Химия [30] |
| Золото [4] |
| Химические элементы в организме человека. [6] |
| Менделеев Дмитрий [7] |
| Органическая химия [7] |
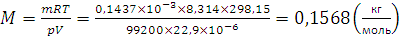
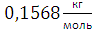
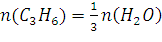
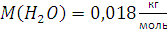 ;
;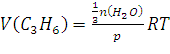 t = 30°С или это 303,15 K;
t = 30°С или это 303,15 K; 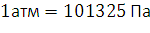 ;
;
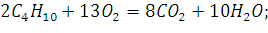 ;
;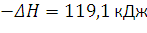
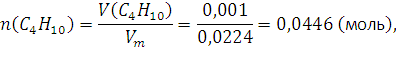
 выделяется
выделяется
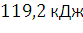 теплоты,
теплоты, 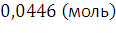
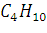 –
– 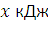 теплоты, тогда
теплоты, тогда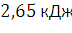
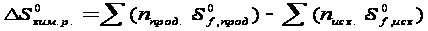
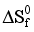 где
ΔH
– изменение
энтальпии
реакции; ΔS
– изменение
энтропии реакции;
Т – температура.
где
ΔH
– изменение
энтальпии
реакции; ΔS
– изменение
энтропии реакции;
Т – температура.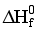 - стандартная
энтропия образования
вещества
- стандартная
энтропия образования
вещества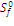 ,
Дж/моль·К
,
Дж/моль·К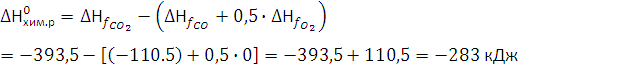
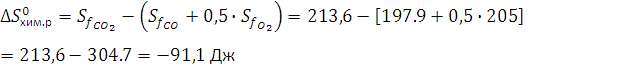
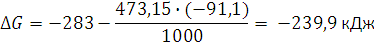
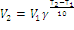
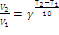
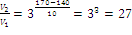
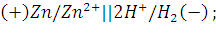
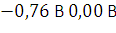
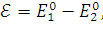
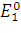 и
и 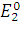 – соответственно
потенциалы
положительного
и отрицательного
электродов.
– соответственно
потенциалы
положительного
и отрицательного
электродов.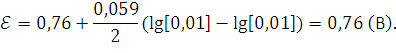
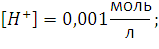
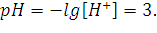
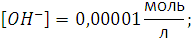
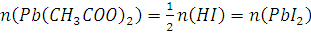
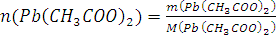
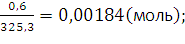
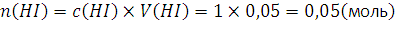
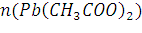 ;
так как
;
так как 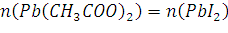 ,
то
,
то