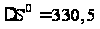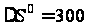| Главная » Статьи » Химия » Химия |
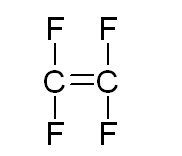
Определение термодинамических параметров реакции полимеризации тетрафторэтиленаРеакция полимеризации имеет вид:
аммония Рассчитаем теплоемкость и некоторые другие термодинамические параметры реагентов и продукта реакции: Тетрафторэтилен:
Проведем расчет теплоемкости тетрафторэтилена по методу Добратца. Согласно этому методу, теплоемкость вещества определяется следующим выражением: , где: CP0 – теплоемкость при низком давлении, [кал/(моль·К)];
для связей
для связей
Общее число связей равно 5. Тогда получим: 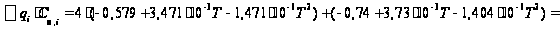
Подставляя полученные выражения в исходную формулу Добратца, получим:
Переходя от калорий к джоулям, получаем: Таким образом, теплоемкость тетрафторэтилена при двух температурах – на входе и выходе из реактора (275 К и 333 К), равна:
Расчет мольной теплоемкости полимера по методу Сато и Шоу (при степени кристалличности 80%):
Тогда (при 298 К):
Учитывая степень кристалличности ПТФЭ, равную 80%, получим теплоемкость при 298 К:
Зная температурную
зависимость
значений
С учетом степени кристалличности находим:
Температурная зависимость теплоемкости политетрафторэтилена имеет вид: Сp(Т)=(0,106+0,003·T)·97,80·0,8+(0,64+0,0012·T)·98,55·0,2= = 20,91+0,26·T [Дж/моль·К]. То есть, коэффициенты уравнения С = f(T) равны: а = 20,91; b = 0,26. Расчет мольной теплоемкости триэтиламина (примеси) по методу Добратца:
С р,0 = 4R + nrR/2 +ΣqiCνi +((3n-6-nr -Σqi)·Σqi Cδ,i) / Σqi R=1,987 кал/моль·К; nr=3, число простых связей, относительно которых может иметь место внутреннее вращение групп; qi-число связей типа i: qN-C =3; qC-C =3; qC-H =15; n=22 - число атомов в молекуле; Σqi=21 - общее число связей в молекуле; Cν i, Cδ,j - функции Эйнштейна для связей типа i. ΣqiCδi = 3(1,016+1,663·10-3T-0,723·10-6·T2)+3(0,503 +2,472 ·10-3·T-1,058·10-6·T2)+ +15(-0,579+3,741·10-3·T - 1,471·10-6·T2) = (-2,619 +75,94·10-3·T- 30,582·10-6·T2); ΣqiCνi = 3(-0,501+3,695·10-3T-1,471·10-6·T2)+3(-0,836 +3,208 ·10-3·T-1,087·10-6·T2)+ +15(-0,139+0,168·10-3·T+0,447·10-6·T2) = (-8,604 +32,85·10-3·T- 4,23·10-6·T2); Тогда:
С р,0=4·1,987
+ При T=298 K: С р,0 = 32,75 кал/(моль·К) = 137,26 Дж/(моль·К); При Т=275 К: С р,0 = 30,42 кал/(моль·К )= 127,68 Дж/(моль·К); При T=333 K: С р,0 = 36,08 кал/(моль·К) = 151,45 Дж/(моль·К). Коэффициенты: а = -0,259; b = 123,17; c = -41,601. Пользуясь методом введения поправок на замещение водорода группами –СН3 и другими (метод Андерсена, Байера и Ватсона), рассчитаем теплоемкость мономера – тетрафторэтилена.
В качестве
основного
вещества примем
метан, для которого 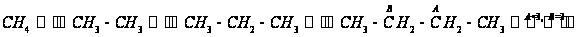
Определение термодинамических параметров реакции полимеризации тетрафторэтилена
Результат
расчета термодинамических
характеристик
тетрафторэтилена
находим суммированием
свойств исходного
вещества (метана)
и всех поправок,
полученных
при построении
углеродного
скелета молекулы
замещением
группами Сводная таблица поправок
Таким образом,
величина Коэффициенты уравнения температурной зависимости: а = -0,838; b = 161,57·10-3; c = -21,83·10-6. Расчет изобарно-изотермического потенциала тетрафторэтилена по методу Ван Кревелена и Чермина:
Таким образом,
Таким образом,
а с учетом эмпирической поправки для перехода мономера из газообразного состояния в кристаллический полимер:
При 298 К:
Тепловой эффект реакции: Qр-ии= -∆Н0 = 18000 кал/моль = 75,42 кДж/моль. ∆S0 гк = 52,5 кал/моль·К= 219,98 Дж/моль·К. Таким образом, реакция является экзотермической. 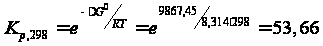 . .Предельная температура полимеризации:
ТПР
= . Выберем температурный интервал и рассчитаем изменение энергии Гиббса, логарифм константы равновесия реакции полимеризации для построения графиков зависимости этих величин от температуры: Изменение теплоемкости в реакции полимеризации определим как разность между теплоемкостью полимера и теплоемкостью мономера:
Энтальпию реакции полимеризации можно определить из уравнения Кирхгофа: 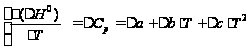 Тогда, после интегрирования: ,
где постоянную
интегрирования
Тогда получим зависимость:
Поскольку зависимость энергии Гиббса от температуры определяется следующим образом: , то после интегрирования можно записать: ,
откуда постоянную
интегрирова-
ния I2
можно определить,
подставив Тогда температурная зависимость энергии Гиббса:
Значение
. Логарифм константы скорости равен: . Рассчитаем ∆Н0 , ∆S0, ∆G0, и lnKp для разных температур. Полученные значения сведем в нижеследующую таблицу:
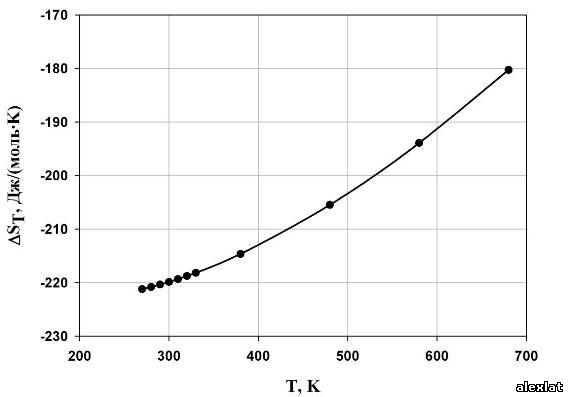
По полученным данным построим графики зависимости термодинамических величин от температуры (рис. 1-4). Исходя из расчетов, можно сделать вывод о том, что с ростом температуры, энтальпия реакции полимеризации стремится в положительную область, а это означает уменьшение теплового эффекта при увеличении температуры проведения процесса. Так же видно, то, что энтропия системы отрицательна, и с возрастанием температуры стремится к нулевому значению. Увеличение абсолютного значения энергии Гиббса также можно определить из графика. В виду того, что энергия Гиббса не на всем интервале температур принимает отрицательные значения, протекание реакции термодинамически вероятно лишь в интервале Т ≈ 340 К. Из графика зависимости константы равновесия от температуры можно сделать вывод о том, что целесообразно проводить реакцию при низких температурах, поскольку при температуре 270 К константа равновесия принимает наибольшее значение, что говорит о сильном смещении равновесия в сторону образования продукта реакции (полимера). 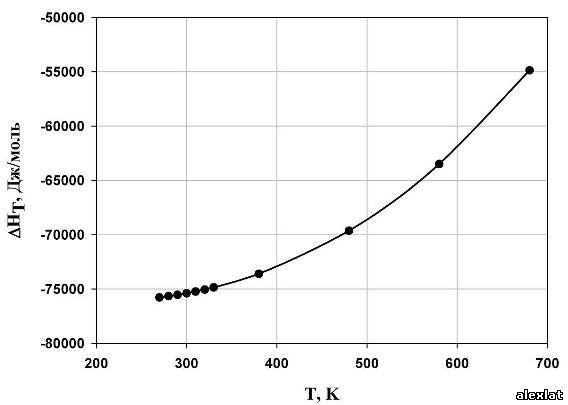 Рис. 1. Зависимость энтальпии реакции от температуры
Рис. 2. Температурная зависимость энтропии реакции 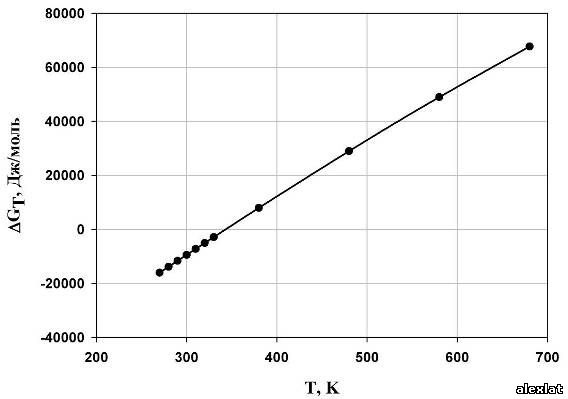 Рис. 3. Зависимость энергии Гиббса от температуры. 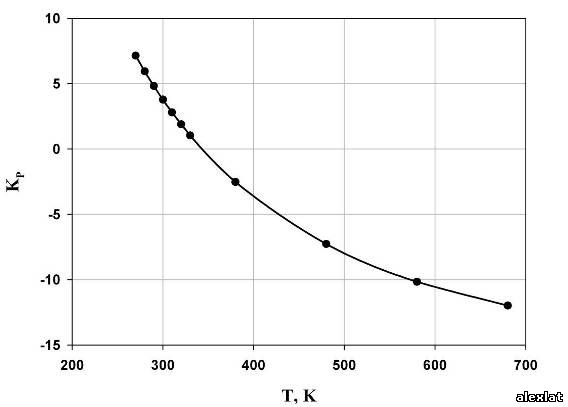 Рис. 4. Температурная зависимость константы равновесия. Рассчитаем предельную температуру проведения полимеризации тетрафторэтилена:
Тпр
= Проведем расчет реакционных способностей для случая сополимеризации тетрафторэтилена и этилена: Эти мономеры имеют следующие значения реакционной способности и полярности (константы Алфрея – Прайса): е Q Тетрафторэтилен 1,22 0,0049 Этилен -0,20 0,015 Тогда:
Получим, что
В сополимере
присутствует
больше этилена,
чем тетрафторэтилена,
поскольку Рассчитаем состав сополимера: Пусть f1 – доля тетрафторэтилена, f2 – этилена в смеси мономеров. Зададим: f1 = 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7; 0,8; 0,9 и, соответственно, f2 = 0,9; 0,8; 0,7; 0,6; 0,5; 0,4; 0,3; 0,2; 0,1. Тогда пользуясь уравнением для расчета состава полимера: , рассчитаем состав сополимера. Результаты расчетов представлены в таблице:
По полученным данным построим график зависимости состава полимера от состава мономера: 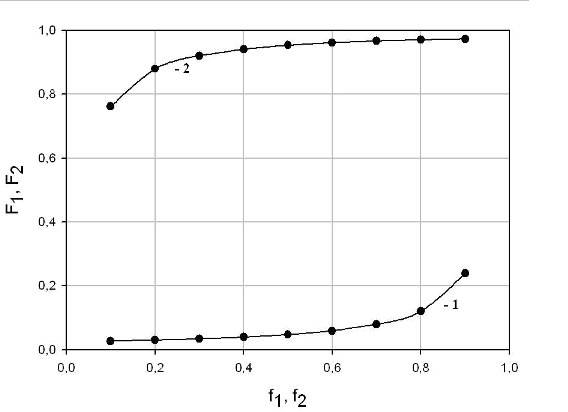 Рис. 5. Зависимость состава полимера от состава мономера 1 – зависимость F1 от f1; 2 – зависимость F2 от f2. Оценка термической устойчивости политетрафторэтилена по температуре полураспада:
Согласно
имеющейся
зависимости
энергии диссоциации
связей от температуры
полураспада,
выбираем связь
в политетрафторэтилене
Диспропорционирование:
Рекомбинация:
Рассчитаем с помощью метода групповых вкладов энергию Гиббса каждой реакции: Диспропорционирование:
Рекомбинация:
Разность изобарно-изотермических потенциалов этих реакций составляет: Таким образом, при температурах выше 38 °С преобладает диспропорционирование, а при Т<38 °С – рекомбинация. Выводы Таким образом, в результате проведенных расчетов термодинамических параметров полимеризации тетрафторэтилена, можно сделать выводы о том, что реакция экзотермическая, термодинамически возможно проводить ее при температурах до ≈340 К. При проведении сополимеризации тетрафторэтилена с этиленом, в сополимере присутствует больше этилена, чем тетрафторэтилена. При температурах выше 38 °С преобладает реакция диспропор- ционирования, ниже 38 °С – рекомбинация. Определена температура полураспада политетрафторэтилена, она составляет около 400 °С. Сопоставляя рассчитанные термодинамические параметры процесса с некоторыми литературными, представленными в нижеследующей таблице:
приходим к выводу, подтверждающему то, что метод Добратца неприменим для расчета термодинамических параметров для неорганических веществ. Кроме этого, рассчитанные значения для тетрафторэтилена и триэтил- амина отличаются от приведенных в литературе. Так, например,
рассчитанное
по методу
Андерсена-Байера-Ватсона
значение | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Просмотров: 2264 | Комментарии: 1 | | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Всего комментариев: 0 | |
| Химия [30] |
| Золото [4] |
| Химические элементы в организме человека. [6] |
| Менделеев Дмитрий [7] |
| Органическая химия [7] |
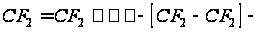
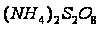
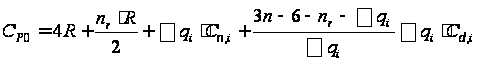
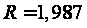 кал/(моль·К)
– универсальная
газовая постоянная;
кал/(моль·К)
– универсальная
газовая постоянная;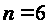 – число атомов
в молекуле
CF2=CF2;
– число атомов
в молекуле
CF2=CF2;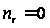 – число простых
связей, относительно
которых может
иметь место
внутреннее
вращение групп;
– число простых
связей, относительно
которых может
иметь место
внутреннее
вращение групп;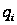 –
число связей
типа
–
число связей
типа 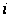 ,
то есть:
,
то есть:
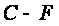
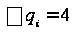 ;
; .
.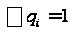
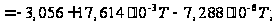
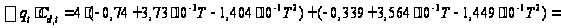
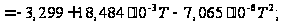
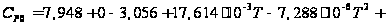
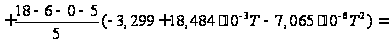
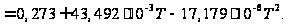
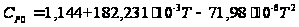 [Дж/(моль·К)].
[Дж/(моль·К)].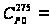 44,814
Дж/(моль·К)=10,695
кал/(моль·К)
и
44,814
Дж/(моль·К)=10,695
кал/(моль·К)
и
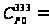 53,845
Дж/(моль·К)=12,851
кал/(моль·К).
53,845
Дж/(моль·К)=12,851
кал/(моль·К).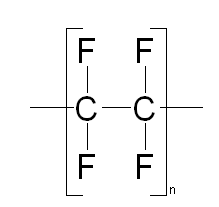
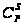 ,
кал/моль·К
,
кал/моль·К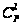 ,
кал/моль·К
,
кал/моль·К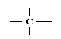
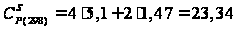 кал/(моль·К)
= 97,80 Дж/(моль·К);
кал/(моль·К)
= 97,80 Дж/(моль·К);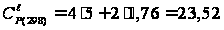 кал/(моль·К)
= 98,55 Дж/(моль·К).
кал/(моль·К)
= 98,55 Дж/(моль·К).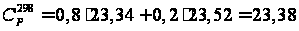 кал/(моль·К)
= 97,95 Дж/(моль·К).
кал/(моль·К)
= 97,95 Дж/(моль·К).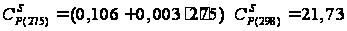 кал/(моль·К);
кал/(моль·К);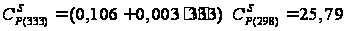 кал/(моль·К);
кал/(моль·К);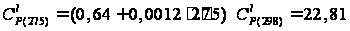 кал/(моль·К);
кал/(моль·К);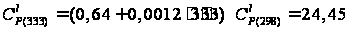 кал/(моль·К);
кал/(моль·К);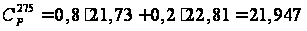 кал/(моль·К)
= 91,956 Дж/(моль·К).
кал/(моль·К)
= 91,956 Дж/(моль·К).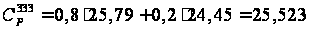 кал/(моль·К)
= 106,941 Дж/(моль·К).
кал/(моль·К)
= 106,941 Дж/(моль·К).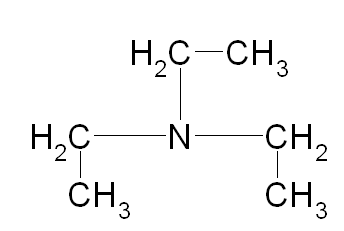
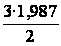 + (-8,604 + 32,85·10-3·T
- 4,23·10-6·T2)
+
+ (-8,604 + 32,85·10-3·T
- 4,23·10-6·T2)
+ 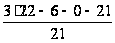 (-2,619 + + 75,94·10-3·T
- 30,582·10-6·T2)=
-0,259 + 123,17·10-3T
- 41,601·10-6T2
[кал/моль·К].
(-2,619 + + 75,94·10-3·T
- 30,582·10-6·T2)=
-0,259 + 123,17·10-3T
- 41,601·10-6T2
[кал/моль·К].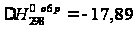 ккал/моль.
Схема построения
самой длинной
углеродной
цепи и замещения
групп:
ккал/моль.
Схема построения
самой длинной
углеродной
цепи и замещения
групп: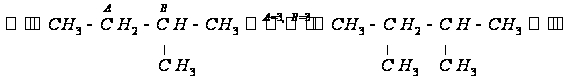
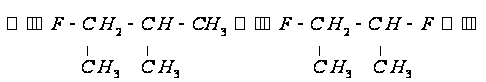
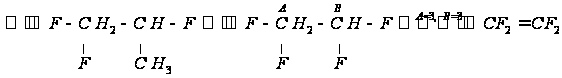
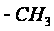 ,
,
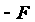 и кратной связью.
Составим сводную
таблицу поправок
с этапами расчета
и полученными
термодинамическими
параметрами:
и кратной связью.
Составим сводную
таблицу поправок
с этапами расчета
и полученными
термодинамическими
параметрами: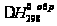 (г),
(г),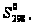 кал/моль·К
кал/моль·К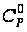 для тетрафторэтилена
составляет
45,37 Дж/моль·К,
для тетрафторэтилена
составляет
45,37 Дж/моль·К,
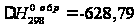 кДж/моль,
кДж/моль,
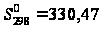 Дж/моль·К.
Дж/моль·К. ы
ы 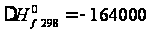 кал/моль
= -687,16 кДж/моль;
кал/моль
= -687,16 кДж/моль;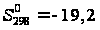 кал/моль =
80,448 Дж/моль·К;
кал/моль =
80,448 Дж/моль·К;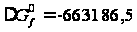 Дж/моль.
Дж/моль.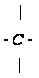
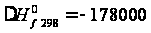 кал/моль
= -745,82 кДж/моль;
кал/моль
= -745,82 кДж/моль;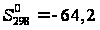 кал/моль =
268,99 Дж/моль·К;
кал/моль =
268,99 Дж/моль·К;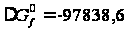 Дж/моль.
Дж/моль.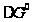 гг
= -178000+64,2·Т –
(-164000+19,2·Т) = -14000 + 45·Т,
гг
= -178000+64,2·Т –
(-164000+19,2·Т) = -14000 + 45·Т,
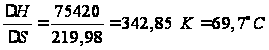
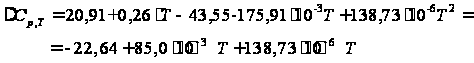
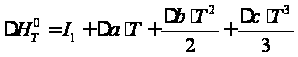
 можно определить,
подставив в
приведенное
выше уравнение
Т = 298 К,
можно определить,
подставив в
приведенное
выше уравнение
Т = 298 К, 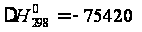 Дж/моль:
Дж/моль: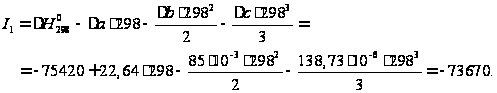
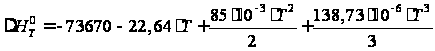
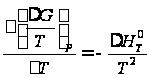
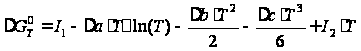
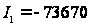 ,
,
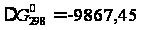 Дж/моль:
Дж/моль: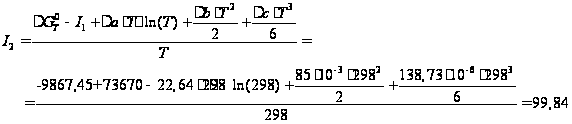
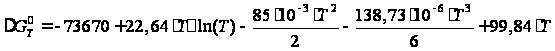
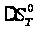 может быть
вычислено по
уравнению:
может быть
вычислено по
уравнению: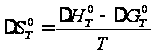
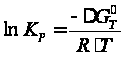
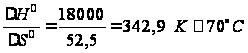
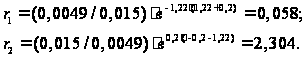
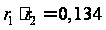 .
Это свидетельствует
о том, что сополимеризация
не является
статистической.
.
Это свидетельствует
о том, что сополимеризация
не является
статистической.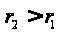 .
.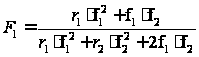
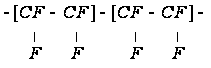 с
наименьшей
энергией диссоциации,
то есть, ту связь,
которая разрывается
легче всего.
Такой связью
является связь
С-С, которая
имеет Едисс
= 98 кал/моль, и
с
наименьшей
энергией диссоциации,
то есть, ту связь,
которая разрывается
легче всего.
Такой связью
является связь
С-С, которая
имеет Едисс
= 98 кал/моль, и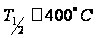 .
.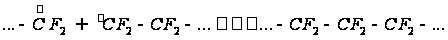
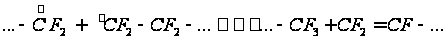
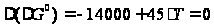 при Т = 311,1 К ≈ 38
°С.
при Т = 311,1 К ≈ 38
°С.