| Главная » Файлы » Химия » Аналитическая химия |
Зависимость оптической плотности раствора
| 05.11.2013, 00:22 | |
Зависимость оптической плотности раствора хлорида кобальта от его концентрации в присутствии тиоцианата аммония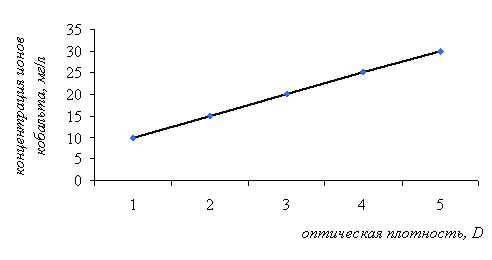 Сорбционную ёмкость по ионам меди и никеля определяли атомно-абсорбционным методом. Для этого готовили растворы хлорида никеля следующих концентраций: 0,5; 12,4; 17,8; 25,3; 35,0 мг/л. Растворы сульфата меди были следующих концентраций: 11,3; 16,3; 25,4; 34,9 мг/л. Влияние массы сорбента на сорбционную ёмкость проводили следующим образом. К навеске тест-сорбента определённой массы добавляли раствор анализируемого иона известной концентрации и оценивали величину сорбционной ёмкости. Данные представлены на рисунке 5. Для данных кривых было получено критериальное уравнение и рассчитана вероятность степени аппроксимации. У1 = -35,711x³ + 72,202x² + 3,5789x + 52,813 (для ионов кобальта) R² = 0,9981; У2 = -29,617x³ + 63,305x² - 7,872x + 69,347 (для ионов никеля) R² = 0,9999; У3 = 61,09x³ - 226,24x² + 275,44x - 10,297 (для ионов меди) R² = 1. Рисунок 5 – Влияние массы сорбента на сорбционную ёмкость  Из графика видно, что максимальная сорбционная ёмкость по ионам кобальта и никеля наблюдалась при массе сорбента 1,2 г, а по ионам меди – 1г. Выбор концентрации растворов исследуемых ионов для постановки данного анализа был обусловлен валовым содержанием этих элементов в объектах окружающей среды. Сорбционная ёмкость влияет на длину окрашенной зоны. В основу количественного определения элементов по величине окрашенной зоны положена особенность, связанная с равномерным распределением веществ в зоне, т.е. пропорциональная зависимость между размерами зон и концентрацией исследуемого раствора. Для этого нами было проведено исследование зависимости длины окрашенной зоны от концентрации анализируемого иона в растворе. Сорбент с иммобилизованным комплексообразователем помещали в стеклянную трубку диаметром 10 мм и длиной 100 мм. Через полученную систему пропускали раствор анализируемого иона известной концентрации. Наблюдалось развитие окраски тест-средства в результате взаимодействия комплексообразователя, закреплённого на носителе с исследуемым ионом. Химизм реакций комплексообразования представлен на рисунке 6. 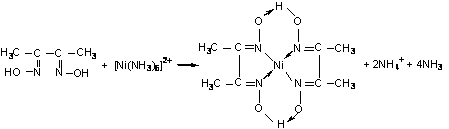 Со2+ + 6SCN- = [Co(SCN)6]4- | |
| Просмотров: 727 | Загрузок: 0 | | |
| Всего комментариев: 0 | |
Категории раздела
| Нестандартные задачи по химии [57] |
| Задачи и примеры по химии [341] |
| Растворы,смеси, сплавы [137] |
| Формулы ,Таблицы, Правила [32] |
| Тесты [114] |
| Аналитическая химия [15] |
| Физическая Химия [113] |
| Расчетные задачи и примеры [165] |
| Задачи-головоломки [107] |
| Химические уравнения [118] |
| Лабораторные работы [10] |
| Коллоидная химия [17] |
| Электрохимия [31] |
Друзья сайта