| Главная » Файлы » Химия » Растворы,смеси, сплавы |
Хром, полученный при электролизе раствора
| 04.11.2013, 17:28 | |
| Хром, полученный при электролизе раствора нитрата хрома(III) обработали соляной кислотой, после чего раствор оставили на воздухе. Затем к этому раствору постепенно прилили раствор NaOH до полного растворения выпавшего вначале осадка. При этом израсходовано 114,3 см³ раствора NaOH с массовой долей 40 % (ρ = 1,40 г/см³). Напишите уравнения реакций и рассчитайте массу выделенного на катоде хрома. Определите объем (н.у.) выделившего газа на аноде. Решение: 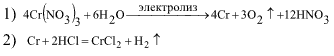 3) 4CrCl2 + O2 + 4HCl = 4CrCl3 + 2H2↑ 4) 3NaOH + CrCl3 = ↓Cr(OH)3 + 3NaCl 5) Cr(OH)3 + NaOH = Na[Cr(OH)4] 6) 4Cr + 12HСl + 3O2 = 4CrCl3 + 6H2O 7) CrCl3 + 4NaOH + = Na[Cr(OH)4] + 3NaCl M(NaOH) = 40 г/моль; M(Cr) = 52 г/моль. Количество NaOH в растворе составит 114,3•1,4•0,4/40 = 1,6 моль. Из уравнений реакций (6, 7) следует, что 1 моль Cr → 1 моль CrCl3 → 4 моль NaOH, т.е. в реакцию с 1,6 моль NaOH вступает 1,6/4 моль хрома или 0,4•52 = 20,8 г. Следовательно, на катоде выделится 20,8 г хрома. Количество кислорода определяем из уравнения реакции (1): оно равно 0,3 моль или 0,3•22,4 = 6,72 дм³ кислорода. | |
| Просмотров: 1108 | Загрузок: 0 | | |
| Всего комментариев: 0 | |
Категории раздела
| Нестандартные задачи по химии [57] |
| Задачи и примеры по химии [341] |
| Растворы,смеси, сплавы [137] |
| Формулы ,Таблицы, Правила [32] |
| Тесты [114] |
| Аналитическая химия [15] |
| Физическая Химия [113] |
| Расчетные задачи и примеры [165] |
| Задачи-головоломки [107] |
| Химические уравнения [118] |
| Лабораторные работы [10] |
| Коллоидная химия [17] |
| Электрохимия [31] |
Друзья сайта