| Главная » Файлы » Химия » Растворы,смеси, сплавы |
После электролиза 200 см³ водного раствора CuSO4
| 04.11.2013, 15:50 | |
| После электролиза 200 см³ водного раствора CuSO4 (ρ = 1,25 г/см³ ) масса раствора уменьшилась на 4,0 г. Оставшийся раствор прореагировал с H2S объемом 1,12 дм³ (н.у.). Определите массовую долю (%) растворенного вещества в исходном растворе. Решение: 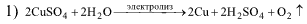 2) CuSO4 + Н2S = ↓CuS + H2SO4. M(CuSO4) = 160 г/моль; M(Cu) = 64 г/моль. Количество H2S равно 1,12/22,4 = 0,05 моль. Следовательно, по реакции (2) количество CuSO4 равно 0,05 моль или 160•0,05 = 8 г. После электролиза останется 8 г CuSO4. Уменьшение массы раствора при электролизе происходит за счет осаждения на катоде меди и выделения кислорода на аноде. Масса раствора сульфата меди(II) равна 200•1,25 = 250 г. Согласно реакции (1) 2 моль CuSO4 → 2 моль Cu → 1моль О2 или 10 г CuSO4 → 4 г Cu → 1 г О2, т.е. при разложении 10 г сульфата меди(II) масса раствора уменьшится на 5 г. Для уменьшения массы раствора на 4 г следует подвергнуть электролизу 10•4/5 = 8 г CuSO4. Общая масса сульфата меди(II) в растворе составит 8 + 8 = 16 г. Поэтому ω(СuSO4) = 16•100/250 = 6,4 %. | |
| Просмотров: 946 | Загрузок: 0 | | |
| Всего комментариев: 0 | |
Категории раздела
| Нестандартные задачи по химии [57] |
| Задачи и примеры по химии [341] |
| Растворы,смеси, сплавы [137] |
| Формулы ,Таблицы, Правила [32] |
| Тесты [114] |
| Аналитическая химия [15] |
| Физическая Химия [113] |
| Расчетные задачи и примеры [165] |
| Задачи-головоломки [107] |
| Химические уравнения [118] |
| Лабораторные работы [10] |
| Коллоидная химия [17] |
| Электрохимия [31] |
Друзья сайта