| Главная » Файлы » Химия » Задачи и примеры по химии |
[Mg²⁺ ] = [Zn²⁺ ]= 1 моль/дм³ .
| 04.11.2013, 17:19 | |
| Составьте схему, напишите электронные уравнения электродных процессов и вычислите э.д.с.магниево-цинкового гальванического элемента, в котором [Mg²⁺ ] = [Zn²⁺ ]= 1 моль/дм³ . Какой металл является анодом, какой катодом? Решение : Схема данного гальванического элемента: (-) Mg | Mg²⁺ ||Zn²⁺ |Zn (+). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс Mgº −2e→Mg²⁺ Цинк, потенциал которого -0,76 В - катод, т.е. электрод на котором протекает восстановительный процесс Zn²⁺ + 2e →Znº Уравнение окислительно-восстановительной реакции, которая лежит в основе работы данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов Mg+Zn²⁺ = Mg²⁺ +Zn Для определения э.д.с. гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 г-ион/дм³ , то э.д.с. элемента равна разности стандартных электродных потенциалов двух его электродов. Поэтому 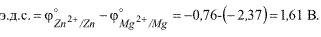
| |
| Просмотров: 558 | Загрузок: 0 | | |
| Всего комментариев: 0 | |
Категории раздела
| Нестандартные задачи по химии [57] |
| Задачи и примеры по химии [341] |
| Растворы,смеси, сплавы [137] |
| Формулы ,Таблицы, Правила [32] |
| Тесты [114] |
| Аналитическая химия [15] |
| Физическая Химия [113] |
| Расчетные задачи и примеры [165] |
| Задачи-головоломки [107] |
| Химические уравнения [118] |
| Лабораторные работы [10] |
| Коллоидная химия [17] |
| Электрохимия [31] |
Друзья сайта